曾荣博士从制药公司的角度分享了如何利用Biomarker(生物标志物)来提高药物研发成功率。曾博士先后介绍了安渡生物公司的情况,生物标志物的定义、分类、应用,以及生物标志物的验证。
-2.png?width=590&height=332&name=640%20(6)-2.png)
安渡生物是以临床药理为主导驱动新药开发,提供符合国际标准的临床开发全链条服务,包括从临床前到上市的临床开发策略和执行,科学地“选剂量、选靶点、选病人” ,并结合全球化质量执行标准,提高新药研发成功率。安渡生物临床全链条服务包括临床药理(A2PG)、生物分析和临床研究。客户群体涵盖从顶尖的初创生物科技公司到跨国制药企业。截至目前,安渡团队已经成功为境内外客户在欧美完成超过210项入市申报(NDA,BLA,MAA)。
-2.png?width=590&height=332&name=640%20(5)-2.png)
安渡生物的创始团队来自于美国阿斯利康的转化科学部门,团队核心成员来自于安进、阿斯利康、诺华,辉瑞以及PPD等。安渡布局全球,覆盖中美欧,实验室位于杭州市萧山区美国的马里兰州和加州(旧金山湾区)。此外,在上海、美国的密歇根州以及欧洲的比利时均有办公室。安渡生物以临床药理为核心,结合机器学习,人工智能等最新的技术,希望能够超越传统以经验为主的建模模拟,全方位(包括生物分析,临床运营管理等)从技术层面上提供支持。安渡生物希望能够提供高效率和高质量的服务,不是作为一个代工企业,而是做一个真正有研发能力的服务型企业。
-3.png?width=590&height=332&name=640%20(4)-3.png)
谈到安渡生物为什么选择研究Biomarker作为重点服务领域,曾博士强调了Biomarker对新药研发的重要性。阿斯利康于2014年和2018年发表在Nature Reviews Drug Discovery的两篇综述文章总结了过去十年间将新药开发从临床前到3期的成功率从4%提升至19%的成功经验和教训,认为这要归功于在“Right Target,Right Tissue,Right Safety,Right Patient,Right Commercial”等5R方面的努力。而5R的每个环节都涉及到Biomarker,可见Biomarker确实在新药研发的过程中发挥了重要作用。
-3.png?width=590&height=332&name=640%20(3)-3.png)
曾博士讲解了FDA和NIH对Biomarker的定义和分类情况。Biomarker可分为七大类,分别是susceptibility/risk,diagnostic,onitoring,prognostic,predictive,pharmacodynamic/response和safety biomarker。曾博士通过案例分享,重点介绍了如何在predictive biomarker,monitoring biomarker以及pharmacodynamic biomarker的帮助下,来选择合适的适应症、患者和临床剂量,从而更好地提高药物研发成功率。
-2.jfif)
第一个案例是关于如何使用受体占有作为PD Biomarker来选择首次人体剂量。临床药理学家采用Translational PK 建模的方法,根据动物体内的PK/PD数据,通过进行模型拟合,得到Exposure-response曲线,然后代入人体PK数据(可以是模拟的数据),就可以预测人体内的受体占有情况。而根据经验,一般受体阻断药物需要受体占有率在90%以上,从而拟合出不同剂量下受体占有率的曲线,帮助科学家选择首次人体剂量。
-3.png?width=590&height=332&name=640%20(2)-3.png)
第二个案例是关于如何使用内源性配体作为PD Biomarker来选择首次人体剂量。正常生理状态下,受体跟配体相结合;当使用与配体竞争性结合受体的药物后,配体被替换下来在血浆中的浓度升高。将不同给药剂量下血浆中的配体浓度与PK数据进行建模,同样可以用于选择首次人体剂量。
-3.png?width=590&height=332&name=640%20(1)-3.png)
第三个案例是关于如何使用多个Biomarker验证药物作用机理和体内的PD效应。研究人员检测了不同剂量给药后可溶性受体含量的变化,可见与对照组相比,即使在最低给药剂量下,受体含量也会有明显的上升。同时也检测了靶基因的表达水平和靶细胞的含量,结果都显示在最低给药剂量时以上指标均有显著性的变化。这些Biomarker 的结果具有一致性,且均在低剂量下趋于稳定,而且与生物活性相关,从而验证药物的POP。
-2.jfif)
前面三个案例都是临床前的例子,第四个案例是使用临床试验中检测的配体含量作为药物作用机理和使用剂量的Biomarker。正常生理下,这个配体的半衰期比较短,而当与药物结合后,配体的半衰期延长。根据不同给药剂量下时间—配体含量的曲线图,结合人体PK进行建模,再根据抑制率超过90%时配体的浓度值,就可确定最低给药剂量。
-2.jfif)
第五个案例是将疾病的进展情况作为Biomarker来帮助评估量效关系,是一种Monitoring Biomarker。总而言之就是将不同剂量下药效对应的biomarker和表征疾病的biomarker的水平对应起来,从而验证最佳给药剂量。
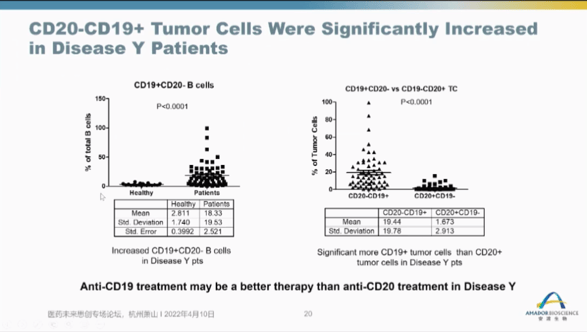
第六个案例是将药物的靶标蛋白/细胞作为预测疗效的biomarker来选择适应症和病人。例如,患有Y疾病的人群其体内CD19阳性CD20阴性的B细胞的含量高于正常健康人群,且Y疾病人群中CD19+CD20-的肿瘤细胞也明显多于CD19-CD20+的肿瘤细胞,提示使用靶向CD19的药物治疗效果会优于靶向CD20的药物。
最后,曾博士详细讲解了如何对Biomarker进行验证。FDA在2018年发布了Biomarker验证指南,框架流程如上图所示。具体来说,首先要进行需求评估,即某种Biomarker能否对一个药物研发或者一个临床试验起到作用。然后要确定这个Biomarker的应用场景(例如是Safety Biomarker 或者 Predictive Biomarker)以及如何应用。接着要评估这一Biomarker的获益和风险。最后需要提供证据支持Biomarker的验证,例如生物学合理性,Biomarker与临床效果的相关性,以及检测方法本身的验证(包括准确度、精密度、灵敏度、选择性、平行性、检测范围、可重复性和稳定性等)。
-2.jfif)
与传统的PK方法学验证不同,Biomarker方法的选择性和平行性评估更重要也更具挑战性。对选择性来说,可以将不同的样本按照不同比例进行混合,计算其回算浓度的偏差。对于平行性来说,通过梯度稀释样本,不仅可以获得平行性的数据,还可以据此确定检查方法的MRD(最低稀释度)和LLOQ(定量下限)。

总结来说,Biomarker确实在新药开发中发挥了重要的作用,但是对Biomarker的应用场景要界定清楚。另外,研究人员需要更重视Biomarker本身的临床验证以及Biomarker 检测方法的验证工作。相信对生物标志物的深入广泛的研究将会使其在新药开发中的价值得到更充分的体现。
-2.png) \
\
-2.png?width=590&height=332&name=640%20(7)-2.png)
-2.png?width=590&height=332&name=640%20(6)-2.png)
-2.png?width=590&height=332&name=640%20(5)-2.png)
-3.png?width=590&height=332&name=640%20(4)-3.png)
-3.png?width=590&height=332&name=640%20(3)-3.png)
-3.png?width=590&height=332&name=640%20(2)-3.png)
-3.png?width=590&height=332&name=640%20(1)-3.png)


